ALTERAZIONI EMATOLOGICHE INDOTTE DA FARMACO NEL CANE E NEL GATTO
È noto che i farmaci possano dare reazioni avverse causando alterazioni ematologiche su una o più linee cellulari, portando a stati di anemia, neutropenia, trombocitopenia o pancitopenia.
I meccanismi fisiopatologici sottostanti possono essere dei più svariati, tra cui una distruzione immunomediata a livello periferico o a livello midollare, uno stress ossidativo o un danno tossico a livello midollare (es. aplasia midollare, necrosi midollare in seguito a fenomeni di vasculite etc).
Nella maggior parte dei casi è sufficiente interrompere il farmaco per eliminarne l’effetto avverso e per poter ripristinare la normale funzionalità midollare.
Le reazioni da farmaco possono essere considerate dose-dipendenti o idiosincrasiche. Quest’ultime sono legate a una predisposizione individuale del paziente a produrre metaboliti reattivi che causano stress ossidativo e/o reazione immunitaria umorale o cellulo-mediata contro un tessuto: sono reazione imprevedibili e indipendenti dai meccanismi di azione del farmaco.
Premettendo che in linea teorica qualsiasi farmaco può indurre una reazione avversa, di seguito riportiamo degli esempi di farmaci la cui somministrazione è più frequentemente associata a possibili alterazioni ematologiche.
Fenobarbitale
È un farmaco comunemente usato per la gestione di pazienti epilettici e in generale è ben tollerato.
È noto che il suo metabolismo epatico possa portare ad alterazioni clinico-patologiche comuni come ipertrigliceridemia, aumento della fosfatasi alcalina (isoforma L-ALP) e marginalmente di ALT e GGT, e che la gravità delle alterazioni è principalmente correlata alla dose a cui il farmaco viene somministrato.
Per questo motivo la funzionalità epatica del paziente deve essere monitorata periodicamente, ovvero dopo tre mesi dall’inizio della terapia e successivamente a cadenza semestrale per tutta la durata del trattamento, come riportato dal Veterinary Epilepsy Task Force (2015).
Gli effetti collaterali potenzialmente più rischiosi per la vita del paziente sono quelli idiosincrasici: i bersagli più comunemente colpiti sono il fegato (epatotossicità acuta), la cute (dermatite necrolitica superficiale), il pancreas (pancreatite) e il midollo osseo e le cellule circolanti.
Da un punto di vista ematologico, la discrasia da fenobabirbitale si presenta sotto forma di citopenie periferiche (combinazione di neutropenia, trombocitopenia e anemia) e clinicamente i pazienti possono manifestare sintomi aspecifici (letargia, abbattimento, mucose pallide, ipertermia): il quadro clinico generalmente è secondario alle infezioni opportuniste per l’immunodepressione data dalla grave neutropenia.
Non è ancora del tutto chiaro il meccanismo che vi è alla base: si ipotizza possa essere conseguente a una distruzione immunomediata delle cellule nel sangue periferico o dei precursori a livello midollare prima che vengano rilasciate in circolo le cellule mature.
Nella specie canina, tale reazione avversa è considerata di bassa prevalenza (4.2% secondo Bersan et al. (2014)) e la sintomatologia e le alterazioni ematologiche compaiono in media dopo sei mesi dall’inizio della terapia. Nel lavoro di Scott et al. (2021), la neutropenia è l’alterazione più comune e di entità più grave: allo striscio ematico è possibile riscontrare segni di tossicità citoplasmatica e left shift variabili (da lievi a gravi).
A livello midollare, è stata identificata prevalentemente iperplasia delle linee citopeniche a livello periferico, con arresti maturativi e spostamenti quindi verso il pool proliferativo (left shift) indicativi di un’ematopoiesi inefficace, evidenziata maggiormente per la linea mieloide. Reperti di citofagia a carico soprattutto della linea eritroide e mieloide sono di comune riscontro. La risoluzione del quadro ematologico avviene in seguito alla sospensione del farmaco, più precocemente per le piastrine (circa 10 giorni), poi per i granulociti neutrofili (circa 2-3 settimane) e infine per gli eritrociti (circa 29 giorni).
Figura 1. Dismielopoeisi indotta da Fenobarbital in un cane con citopenie periferiche multiple. Si osserva ipoplasia della linea eritroide, anomala maturazione della linea mieloide/granulocitica con tendenza all'arresto maturativo allo stadio di granulocita bandato e apoptosi dei granulociti stessi.
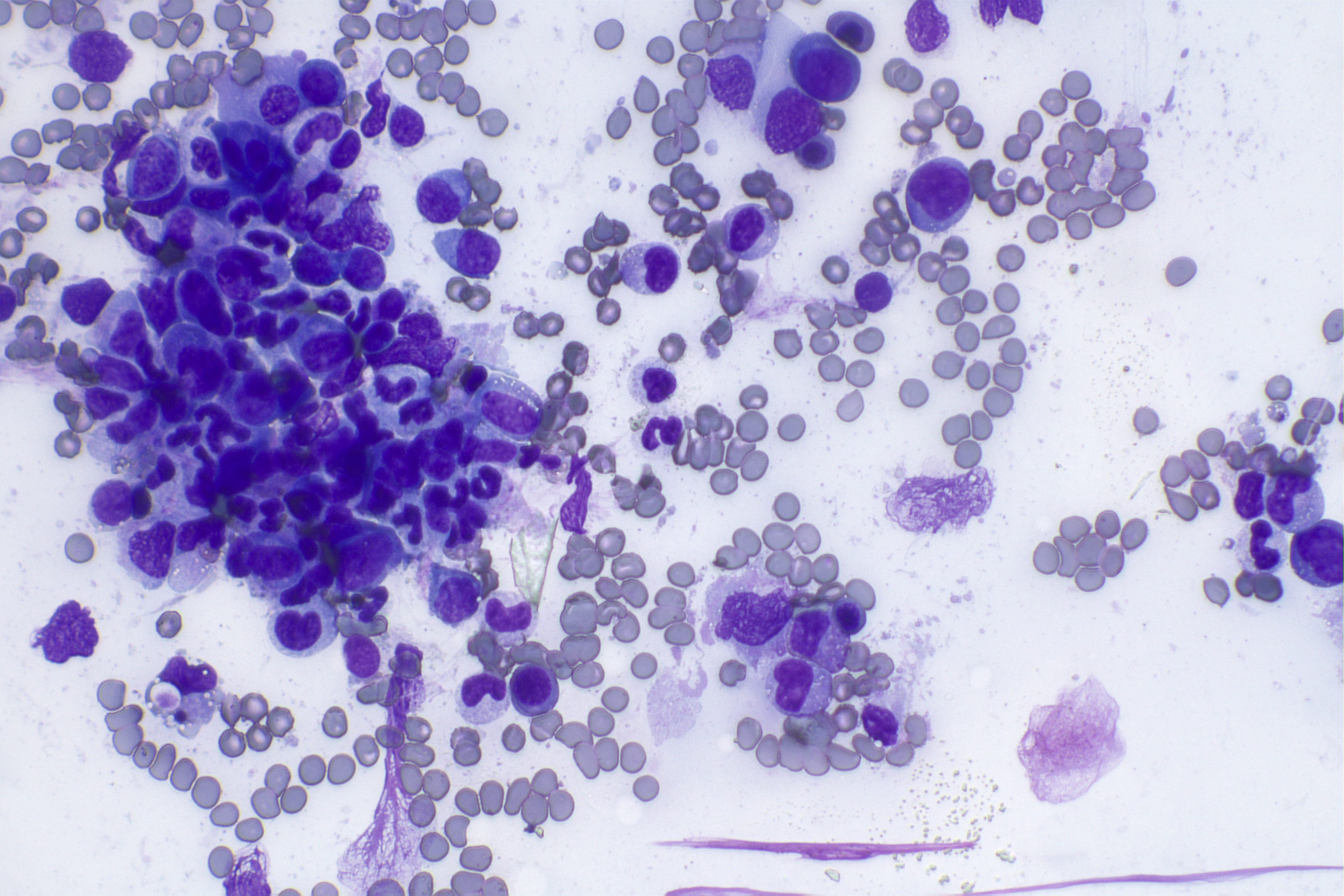
A differenza del cane, dal lavoro di Dohany et al. (2023) si evince che nel gatto le alterazioni ematologiche siano molto comuni (76.8%) ma di lieve-moderata entità e principalmente a carico dei granulociti neutrofili (circa il 60% manifesta lieve-moderata neutropenia), e compaiono in corso di terapia cronica e non nelle fasi iniziali del trattamento. I pazienti solitamente sono asintomatici salvo in corso di gravi neutropenie (solamente 1.5% dei soggetti manifesta alterazioni ematologiche gravi).
Cortisone
La terapia con cortisone va a mimare l’effetto dei glucocorticoidi endogeni, per cui è possibile riscontrare all’esame emocromocitometrico:
- Trombocitosi: riscontro comune, anche se il meccanismo fisiopatologico secondario alla somministrazione di questo farmaco non è del tutto noto;
- Leucogramma da stress (neutrofilia, linfopenia, monocitosi (solo per la specie canina) e eosinopenia). La neutrofilia e l’eosinopenia sono i più comunemente riscontrati (Masters et al. 2018).
Non è noto se queste alterazioni siano più evidenti in corso di dosaggio immunosoppressivo o antinfiammatorio; si ipotizza possa esserci una correlazione con la dose del farmaco.
Azatioprina
È un farmaco immunosoppressore utilizzato per il controllo di patologie autoimmuni o immunomediate. Oltre all’epatotossicità, come effetto avverso verosimilmente idiosincrasico (anche se in medicina umana è stata studiata una possibile correlazione genetica), può portare a mielosoppressione: all’esame citologico del midollo osseo si osserva un’ipoplasia midollare, e se non riconosciuta per tempo, può evolvere ad anemia aplastica e mielofibrosi.
Le citopenie a livello di sangue periferico insorgono in base all’emivita delle cellule del sangue, per cui compare prima la neutropenia, poi la trombocitopenia e infine l’anemia non rigenerativa; per questa ragione le prime due alterazioni sono più frequentemente osservabili, mentre raramente si evidenziano stati di anemia gravi. In seguito alla sospensione permanente del farmaco, la risoluzione delle citopenie si ha tra i 10 giorni e le 8 settimane (Rinkardt e Kruth. 1996).
È consigliato eseguire un monitoraggio ematologico settimanale per i primi mesi di trattamento, per poi dilazionare a una volta al mese in corso di terapie croniche, al fine di identificare precocemente tale reazione avversa.
Metimazolo/carbimazolo
Sono entrambi farmaci utilizzati nella specie felina per il controllo dell’ipertiroidismo.
In corso di terapia con metimazolo, sono stati segnalati da Peterson et al. (1988) per lo più lievi alterazioni ematologiche (16.4%) nei primi mesi del trattamento, quali eosinofilia, linfocitosi, lieve leucopenia. Nel 3.8% dei casi sono state invece segnalate gravi neutropenie e trombocitopenie. Altri lavori riportano anche la possibilità di sviluppare anemia aplastica (Weiss. 2006). Tutte le alterazioni riscontrate all’emocromo sono reversibili dopo una settimana dall’interruzione del trattamento.
Un case report (Mosca e Bresciani. 2016) segnala una potenziale anemia emolitica immunomediata in seguito a somministrazione di carbimazolo, che in linea teorica dovrebbe avere reazioni avverse minori rispetto al metimazolo.
Per questa ragione, si consiglia un monitoraggio ematologico ogni due settimane per i primi tre mesi di trattamento, periodo entro il quale dovrebbero comparire più frequentemente le alterazioni ematologiche sopra descritte.
Farmaci chemioterapici
A seconda del farmaco utilizzato gli effetti a livello ematologico possono essere differenti.
Ad esempio, la vincristina stimola direttamente la produzione e il rilascio di piastrine, inducendo la trombocitosi nel paziente. Nello stesso tempo, è responsabile di una diseritropoiesi transitoria (es. presenza di corpi di Howell-Jolly e residui nucleari eritrocitari a livello di sangue periferico) in assenza di anemia (Collicutt e Garner, 2013).
I chemioterapici citotossici hanno come target le cellule ad elevata replicazione come lo sono le cellule ematopoietiche e la mielosoppressione è solitamente dose-dipendente; il reperto ematologico di più comune riscontro è quindi la neutropenia.
Questo tipo di condizione è riportata più frequentemente sia nel cane che nel gatto in corso di protocollo chemioterapico per linfoma (Pierro et al. 2016; Sorenmo et al. 2010). Inaspettatamente è stato dimostrato che in corso di linfoma nel cane la neutropenia indotta da chemioterapia sia un marker prognostico favorevole (Wang et al. 2015).
A livello di striscio ematico, è possibile riscontrare oltre ai corpi di Howell-Jolly per la diseritropoesi da vincrisrina, anche un numero variabile di eritrociti nucleati (normoblastemia) soprattutto in corso di protocollo CHOP per linfoma nel cane; questo reperto si è ipotizzato essere il risultato di una aumentata permeabilizzazione della barriera emato-midollare indotta dai farmaci (Moretti et al. 2015).
Acetaminofene (paracetamolo)
È un farmaco antipiretico e analgesico comunemente utilizzato in medicina umana.
I gatti sono estremamente sensibili agli effetti tossici dei metaboliti di questo farmaco principalmente per deficit enzimatici di coniugazione dello stesso (deficit relativi alla via metabolica della coniugazione della glucoronide). Gli eritrociti sono le cellule più fragili e sensibili all’accumulo di questi metaboliti e subiscono uno stress ossidativo: reperti a questo correlati sono l’anemia emolitica da stress ossidativo (sospettata per la presenza di numerosi corpi di Heinz ed eccentrociti alla valutazione dello striscio ematico), la metaemoglobinemia e la metaemoglobinuria. Nel gatto non vi è nessuna dose considerata sicura, pertanto questo farmaco non deve essere utilizzato nella specie felina (Allen, 2003).
Nella specie canina, invece, è maggiormente tollerato salvo in corso di carenze enzimatiche congenite necessarie per la metabolizzazione del farmaco (MacNeughton, 2003).
Altri farmaci da segnalare che possono causare aplasia/ipoplasia midollare sono:
- FANS: fenilbutazone, acido meclofenamico, carprofene;
- Antibiotici: sulfamidici-trimetoprim, cefalosporine. Le cefalosporine possono inoltre agire da trigger per anemie emolitiche immunomediate;
- Altri farmaci: albendazolo, fenbendazolo, tiacetardamide, captopril, griseofulvina, micofenolato, levamisolo;
- Estrogeni esogeni
Bibliografia:
- The diagnosis of acetaminophen toxicosis in a cat. Can Vet J Volume 44. 2003
- Bersan et al. Phenobarbitone-induced haematological abnormalities in idiopathic epileptic dogs: prevalence, risk factors, clinical presentation and outcome. Veterinary Record. 2014
- Collicutt and Garner. Erythrocyte dysplasia in peripheral blood smears from 5 thrombocytopenic dogs treated with vincristine sulfate. Vet Clin Pathol 42/4.458–464. 2013
- Dohány et al. A retrospective evaluation of phenobarbital-induced hematologic changes in 69 cats. Vet Clin Pathol.52:601–606. 2023
- Veterinary Hematology, a Diagnostic Guide and Color Atlas. First Edition Elsevier, 2012
- Acetaminophen toxicosis in a Dalmatian. Can Vet J Volume 44, 2003
- Masters et al. Effects of short-term anti-inflammatory glucocorticoid treatment on clinicopathologic, echocardiographic, and hemodynamic variables in systemically healthy dogs. Vol 79; 4. 2018
- Moretti et al. Nucleated erythrocytes in blood smears of dogs undergoing chemotherapy. Veterinary and Comparative Oncology. 2015
- Mosca and Bresciani. Life-threatening haematological complication occurring in a cat after chronic carbimazole administration. JFMS. 2016
- Peterson et al. Methimazole treatment of 262 cats with hyperthyroidism. J Vet Intern Med. 2: 150–157. 1988
- Pierro et al. Febrile neutropenia in cats treated with chemotherapy. Veterinary and Comparative Oncology. 2016
- Podell et al. 2015 ACVIM small animal consensus statement on seizure management in dogs. J Vet Intern Med. 30:477–490. 2016
- Rinkardt and Kruth. Azathioprine-induced bone marrow toxicity in four dogs. Can Vet J. 37:612-613. 1996
- Scott et al. Bone marrow, blood, and clinical findings in dogs treated with phenobarbital. Vet Clin Pathol.50:122–131. 2021
- Sorenmo et al. Case-control study to evaluate risk factors for the development of sepsis (neutropenia and fever) in dogs receiving chemotherapy. JAVMA, Vol 236, No. 6. 2010
- Wang et al. Chemotherapy-induced neutropenia is associated with prolonged remission duration and survival time in canine lymphoma. The Veterinary Journal 205. 69–73. 2015
- Aplastic anemia in cats e clinicopathological features and associated disease conditions 1996-2004. J Feline Med Surg. 8(3):203-6. 2006
Giulia Mangiagalli, Med. Vet. EBVS European Specialist in Veterinary Clinical Pathology (Dipl. ECVCP); Esperto MYLAV in Patologia Clinica
Commenti
- Nessun commento trovato








Lascia i tuoi commenti
Login per inviare un commento
Posta commento come visitatore