CITOFLUORIMETRIA: QUANDO, COME E PERCHE’
La citofluorimetria è una tecnica diagnostica avanzata utile in casi di sospetta neoplasia ematopoietica, per confermare la diagnosi, definire l’immunofenotipo e stadiare la neoplasia stessa.
Al momento, non è possibile valutare neoplasie di altra origine, come carcinomi e sarcomi.
La citofluorimetria permette di definire la linea di origine e lo stadio maturativo delle cellule ematopoietiche presenti nel campione, tramite l’utilizzo di anticorpi monoclonali, che permettono di identificare l’insieme di proteine presenti su ciascuna cellula (pattern antigenico), che è caratteristico appunto di ciascuna linea cellulare e varia in funzione dello stadio di maturazione.
Attraverso l’analisi di tali dati, è quasi sempre possibile distinguere forme neoplastiche da forme reattive.
Quando?
L’esecuzione della citofluorimetria è indicata ogni volta che si è ha un sospetto clinico di neoplasia ematopoietica (es. leucemie e linfomi), se supportato dai rilievi ematologici, midollari e citologi.
La citofluorimetria non deve quindi essere intesa come primo step diagnostico, ma deve essere richiesta solo se vi sia indicazione clinica o citologica.
I dati ottenuti dalla citofluorimetria, infatti, devono essere interpretati alla luce del quadro clinico del paziente e dell’aspetto morfologico delle cellule. Quadri citofluorimetrici simili possono avere significati diversi in base alle condizioni cliniche e alle terapie pregresse.
Come?
La citofluorimetria si esegue su cellule in una sospensione cellulare e quindi su un mezzo liquido.
Campioni come sangue, versamenti o midollo osseo possono essere inviati al laboratorio in provetta con EDTA.
Per analizzare invece lesioni solide (linfonodi aumentati di volume, neoformazioni, parenchima splenico infiltrato, ecc) è necessario effettuare un campionamento tramite ago aspirato/infissione come per la citologia, e risospendere le cellule in medium liquido.
A questo scopo, è possibile utilizzare siero (0.5-1 ml) dello stesso paziente, eventualmente diluito in fisiologica se necessario, oppure terreni per colture cellulari cme l'RPMI. Questi accorgimenti permettono di mantenere le cellule vitali più a lungo, ma è comunque importante che il campione sia consegnato al laboratorio entro 24 ore dal prelievo.
Al contrario, è controindicato risospendere le cellule in soluzione fisiologica senza aggiunta di siero autologo, in quanto le cellule andrebbero incontro a rapida degenerazione. E’ infatti fondamentale che le cellule siano vitali al momento dell’analisi, in quanto degenerazioni anche solo parziali possono compromettere il legame degli anticorpi monoclonali e quindi falsare i risultati.
Infine, è importante inviare al laboratorio anche dei vetrini del campione in esame, adeguatamente preparati e fissati, per permettere la valutazione morfologica tramite un esame citologico.
Siccome l'analisi può essere eseguita se il liquido contenente la sospensione cellulare contiene un numero sufficiente di cellule nucleate (leucociti normali o neoplastici), è consigliabile effettuare un controllo prima dell'invio della provetta al laboratorio quando si aspirano organi solidi e le cellule vengono poi spruzzate nel medium di trasporto: a tale scopo è sufficiente effettuare delle conte cellulari con una normale contaglobuli per ematologia (se disponibile in struttura) e inviare la provetta solo se al suo interno sono contenuti >10.000 leucociti. In caso contrario è meglio ripetere ulteriori FNA dall'organo da analizzare per aumentare la concentrazione delle cellule nella sospensione.
E’ importante, infine, eseguire la citologia e la citofluorimetria prima di qualsiasi intervento terapeutico (compatibilmente con le esigenze cliniche), in quanto le terapie corticosteroidee o chemioterapiche causano lisi delle cellule linfoidi e neoplastiche più in genere, conducendo a campioni non diagnostici.
Figura 1. Procedura di campionamento da lesioni solide e preparazione del campione da inviare per la citofluorimetria.
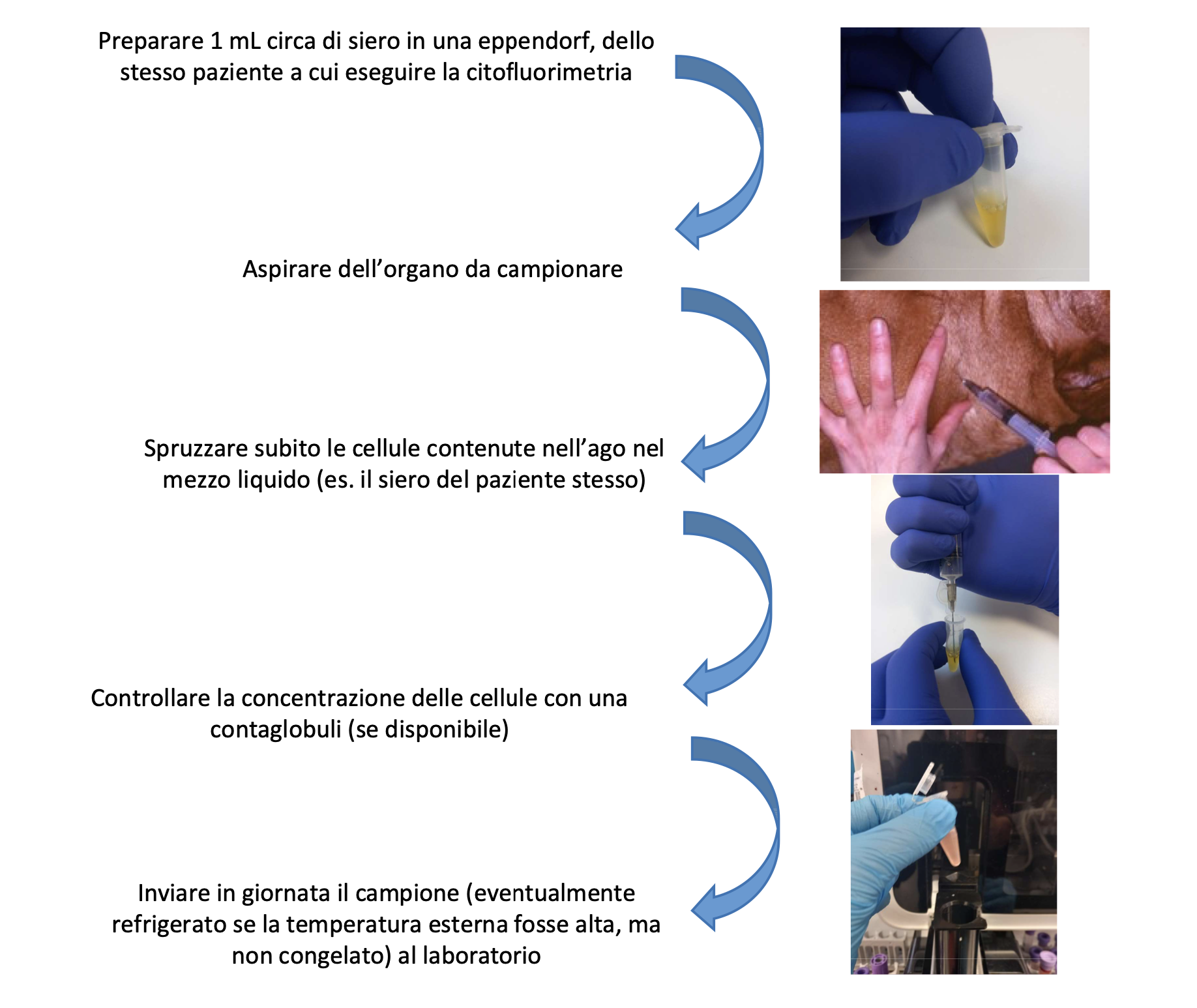
Perché?
Il principale vantaggio della citofluorimetria è rappresentato sicuramente dalla tipologia di prelievo (ago aspirato/infissione), meno invasivo rispetto ad una biopsia chirurgica. Molto spesso la citologia è sufficiente infatti a dare un’indicazione di neoplasia ematopoietica/a cellule rotonde. In alcuni casi, però, il quadro citologico può essere di più difficile interpretazione e solo ulteriori test come la citofluorimetria permettono di confermare o meno la presenza di neoplasia
Rispetto alle altre tecniche utilizzate per l’immunofenotipizzazione (immunocitochimica o immunoistochimica), è possibile analizzare un maggior numero di marker sulle stesse cellule, anche contemporaneamente, permettendo quindi una più approfondita identificazione delle cellule e quindi classificazione della neoplasia. La citofluorimetria permette di giungere ad una tipizzazione cellulare con tempistiche molto ridotte (di solito entro 48h) e con costi limitati e deve essere utilizzata per confermare e classificare le neoplasie ematopoietiche.
Tuttavia, la citofluorimetria non permette la valutazione morfologica delle cellule, motivo per cui deve essere preceduta o accompagnata da un esame citologico. Inoltre in alcune situazioni è necessario valutare la distribuzione nei tessuti delle cellule neoplastiche, informazione che può essere ottenuta solo tramite un esame istologico.
Associata al quadro citologico, è fondamentale per classificare correttamente la neoplasia ematopoietica, al fine di emettere una prognosi corretta e stabilire il giusto iter terapeutico.
In funzione della morfologia e del pattern antigenico delle cellule nel campione, è possibile ad esempio distinguere:
- linfomi a fenotipo B
- linfomi a fenotipo T
- linfomi T-zone (solo nel cane)
- iperplasia linfonodale di origine reattiva
- leucemia linfoidi croniche a fenotipo B
- leucemia linfoidi croniche a fenotipo T
- leucemie acute (linfoidi, mieloidi o non differenziabili)
- linfocitosi di origine reattiva
Figura 2. Esame citologico, immunocitochimico (con positività al CD20) e citofluorimetrico di un caso di linfoma B a grandi cellule del cane. La popolazione cellulare è costituita quasi esclusivamente da elementi linfoidi voluminosi a fenotipo CD45/CD21/MHC+ e negativi invece per il marker linfoide T (CD3).
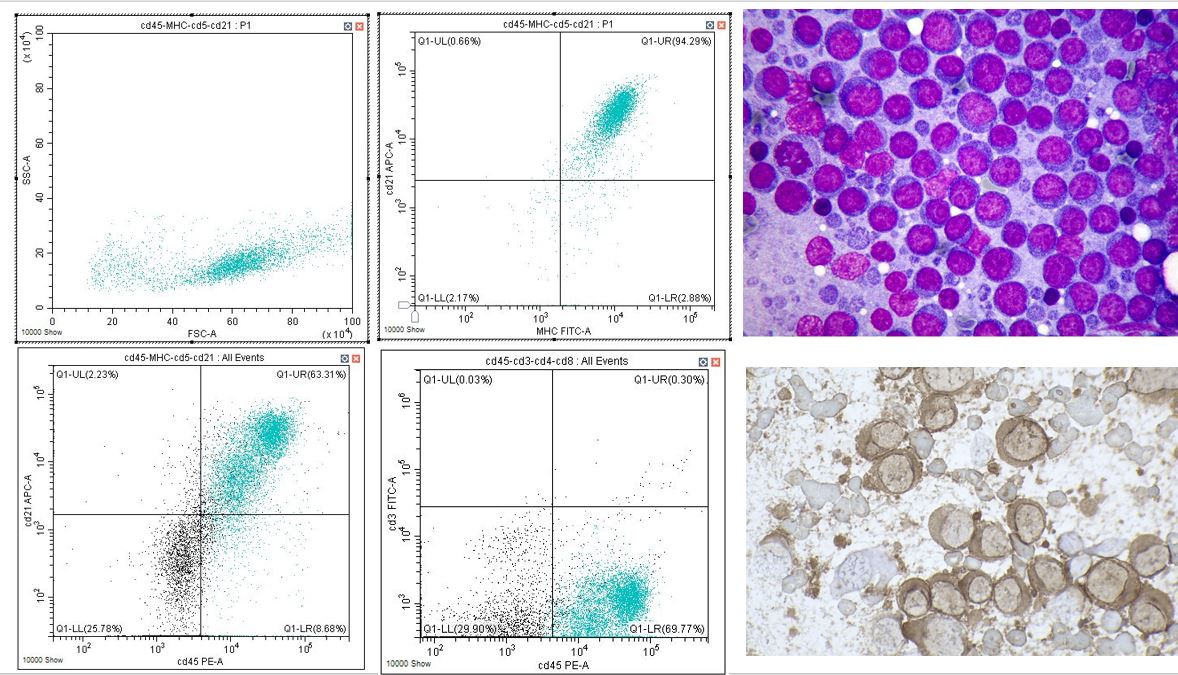
La citofluorimetria non è invece utile per analizzare leucocitosi causate da cellule mature normali della linea neutrofilica, eosinofilica e monocitica, in quanto non aggiunge nulla a quanto già valutabile con un normale emogramma.
Per una corretta diagnosi e gestione clinica del singolo caso, sarebbe opportuno analizzare sempre tramite citofluorimetria sia la lesione primaria (per esempio il linfonodo aumentato di volume) che sangue e midollo. Questo approccio permette inoltre di effettuare una stadiazione della patologia, ossia di quantificare l’infiltrazione dei diversi distretti, registrando la percentuale di cellule con caratteristiche sovrapponibili a quelle della lesione principale.
La stadiazione dei linfomi al momento della diagnosi ha un importante ruolo prognostico e terapeutico, oltre a permettere il monitoraggio della malattia dopo terapia.
A questo scopo, infatti, è possibile ricorrere alla citofluorimetria al termine del protocollo chemioterapico, per valutare la malattia minima residua, cioè quantificare nelle diverse matrici (linfonodo, sangue, midollo, ecc.) la percentuale di cellule neoplastiche ancora presenti. Questo può essere fatto purché sia noto il fenotipo della neoplasia prima della terapia. Anche questa valutazione ha valore prognostico e terapeutico, in quanto soggetti con malattia residua potrebbero beneficiare di ulteriore trattamento in funzione del tipo di neoplasia.
Al di fuori delle neoplasie ematopoietiche, può essere usata anche per la diagnosi di timoma nel cane, come descritto nella figura seguente.
Figura 3 - Esame citologico e citofluorimetrico di massa mediastinica di cane: si rileva una popolazione di piccoli linfociti frammisti a cellule epiteliali neoplastiche. Questa popolazione linfocitaria mostra il classico fenotipo dei timociti (linfociti T di derivazione timica), con la doppia co-espressione di CD4 e CD8, confermando il sospetto di timoma ricco in linfociti.
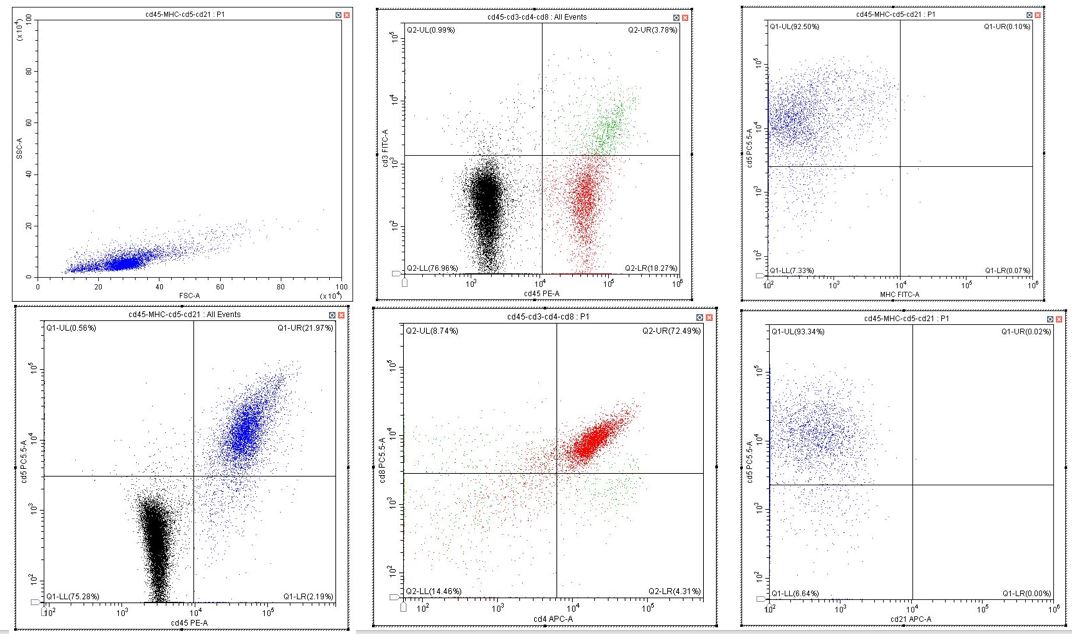
Valeria Martini, Med. Vet., PhD, Esperto MYLAV in Citofluorimetria
Walter Bertazzolo, Med. Vet. EBVS European Specialist in Veterinary Clinical Pathology (Dipl. ECVCP); Direttore Scientifico di MYLAV
Commenti
- Nessun commento trovato








Lascia i tuoi commenti
Login per inviare un commento
Posta commento come visitatore