Tutto quello che devi sapere dei tumori melanocitici del cane
I tumori melanocitici sono molto comuni nel cane. Sono più frequenti a livello orale (dalla mucosa o dalla giunzione mucocutanea di labbra e guancia) e cutaneo (in aree con pelo, letto ungueale e polpastrello); più raramente, sono rilevabili a livello di seno paranale, altre giunzioni mucocutanee (perianale e, potenzialmente, anche prepuziale o vulvare), tartufo e cavità endonasali; a livello dell’occhio, il melanoma è rilevabile nel cane a livello epibulbare, uveale e congiuntivale. Occasionalmente, possono originare anche in altre sedi.
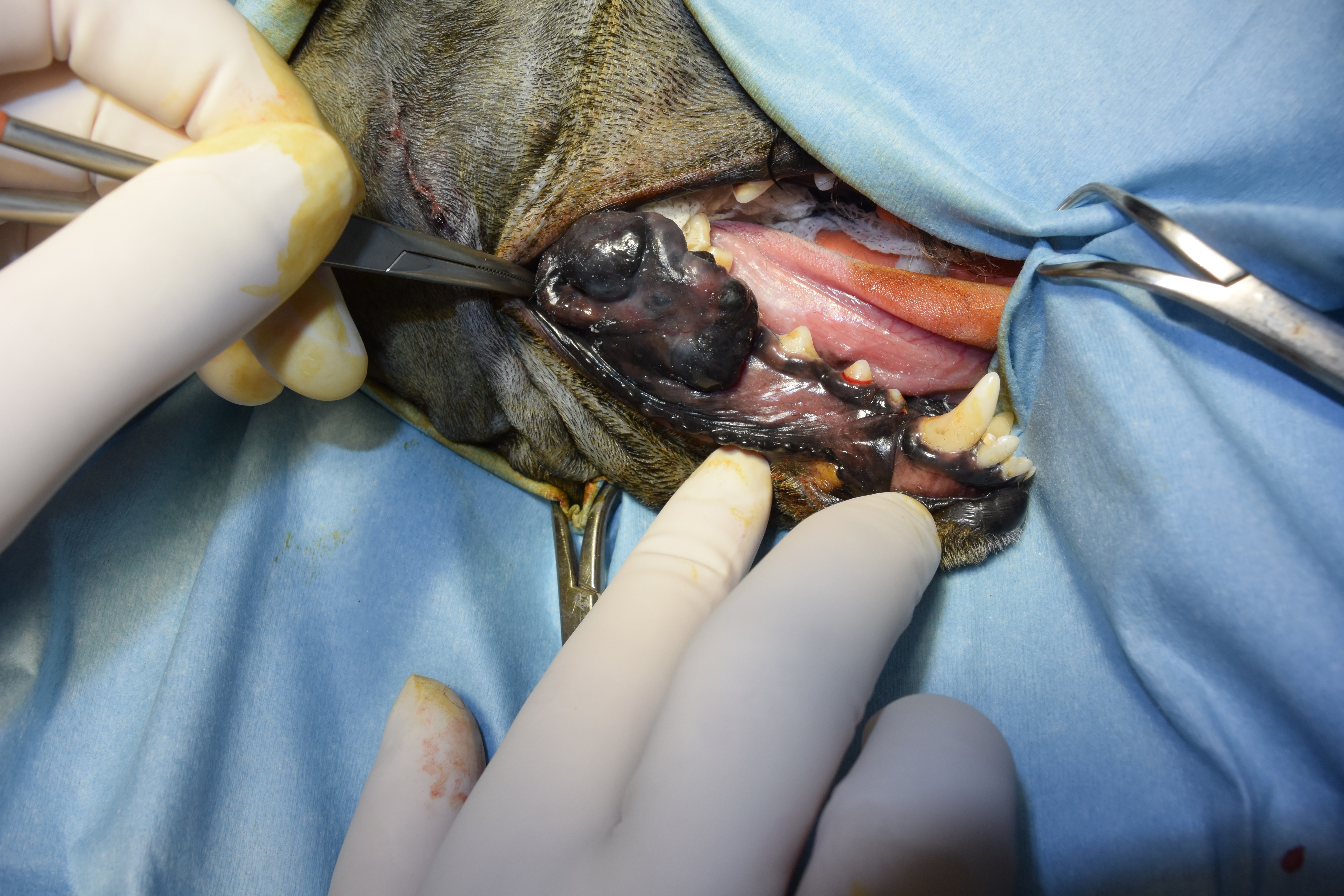
Fig. 1 - Melanoma orale
Specifiche e definizioni utili
|
Melanocitoma |
tumore cutaneo a comportamento benigno (Smedley et al 2022) |
|
Tumore melanocitico |
|
|
Melanoma dermico o composto (Smedley et al 2022) |
|
|
Attività giunzionale a livello di epiteli (Smedley et al 2022) |
|
|
Melanoma maligno |
|
|
Melanoma amelanotico |
|
Diagnosi
- Citologia e/o istologia: diagnosi più complessa per le neoplasie melanocitarie non pigmentate (amelanotiche).
- Biopsia incisionale (con bisturi o punch): procedura più sicura per ottenere la diagnosi.
- A livello orale dovrebbe coinvolgere anche un’area epiteliale apparentemente intatta prossima alla parte ulcerata per rilevare all’esame istologico l’eventuale attività giunzionale.
- Mai opportuna la biopsia escissionale marginale in assenza di diagnosi certa; se eseguita, è opportuno procedere con un’escissione en bloc, eseguendo cioè la rimozione della lesione insieme a un adeguato margine di tessuto macroscopicamente sano intorno al tumore.
- Caratteristiche citologiche e istologiche:
- differenziazione con i carcinomi (in assenza di attività giunzionale): valutazione immunoistochimica con pancitocheratina;
- differenziazione con i sarcomi: più problematica. Se l’immunoistochimica è negativa al cocktail anticorpale standard per l’istotipo melanocitario, l’esito istologico definitivo può essere di “sarcoma indifferenziato;
- anche l’utilizzo di altri markers (ad esempio SOX-10) non fornisce risultati definitivi (Smedley et al 2022);
- si è suggerita recentemente, per discriminare il melanoma orale dal sarcoma dei tessuti molli, la valutazione quantitativa dell’espressione su RNA di TYR, CD34 e CALD (Tsoi et al 2021).
- se ben differenziato le cellule possono essere rotonde, epiteliodi o fusate;
- possibili istologicamente i quadri misti, con quantità variabile di granuli di melanina;
- nelle forme indifferenziate le cellule possono assumere anche altre forme (signet ring, spiraloidi, etc), con melanina scarsa o assente (Smedley et al 2022).
- Immunoistochimica: utile per i melanomi amelanotici (cocktail di anticorpi contro Melan A, PNL2, TRP-1 e TRP- 2, con sensibilità fino al 93%);
Fattori prognostici
- Clinici
- non definitive per la diagnosi sia la palpazione sia la diagnostica per immagini (anche avanzata) per il fatto che il linfonodo può essere micrometastatico;
- la valutazione citologica è da considerarsi definitiva in caso di metastasi accertata, non così se la diagnosi è di linfonodo reattivo in quanto un eventuale focolaio micrometastatico può essere stato omesso (Grimes et al 2017);
- per l’escissione del/i linfonodo/i contestuale all’escissione del tumore primario, ideale è la mappatura del/i linfonodi sentinella pre-chirurgia seguita da linfadenectomia selettiva;
- i linfonodi escissi sono avviati, insieme al tumore primario, ad indagine istopatologica. Se la mappatura non è stata eseguita, devono essere escissi i linfonodi regionali dell’area;
- in caso di assenza di melanina l’immunocitochimica positiva per Melan-A (e negativa per citocheratina e vimentina) può rivelarne l’origine melanocitaria (Przeździecki et al 2015) ma i risultati possono non essere del tutto attendibili.
- Razza: anche se alcune razze sono segnalate come predisposte, tale parametro non è discriminante.
- Sesso: non determinante.
- Età: non del tutto determinante; i cani anziani tenderebbero comunque a sviluppare tumori melanocitari più aggressivi (Spangler and Kass 2006) e/o essere più predisposti a complicanze nel corso dei diversi trattamenti.
- Localizzazione: quello orale è il più aggressivo, aggressività intermedia/alta è attribuita al melanoma delle giunzioni muco-cutanee mentre una minor aggressività caratterizzerebbe il melanoma cutaneo (aree con pelo) (Smedley et al 2011, Spangler and Kass 2006; Laver et al 2018; Porcellato et al 2020).
- Ulcerazione: anche se considerato come fattore prognostico negativo per il melanoma cutaneo (Laprie et al 2001), l’ulcerazione non può essere considerata determinante in quanto altri fattori possono contribuire a determinarne la comparsa, come ad esempio l’autotraumatismo (Smedley et al 2022).
- In generale: l’aggressività di un melanoma (a qualsiasi localizzazione) è determinata integrando i fattori prognostici clinici (localizzazione, aspetto macroscopico e stadiazione clinica TNM) e quelli istologici e immunoistochimici (Smedley et al 2022).
- Valutazione dei linfonodi regionali/sentinella
- Istologici
- Melanoma orale: un cut-off di 30% di nuclei atipici è utilizzato per differenziare i melanomi tipicamente maligni da quelli meno aggressivi (Bergin et al 2011; Spangler and Kass 2006; Silvestri et al 2018; Vargas et al 2019).
- Melanoma cutaneo: un cut-off del 20% è impiegato per discriminare una maggior o minor aggressività (Bergin et al 2011; Spangler and Kass 2006; Smedley et al 2011; Silvestri et al 2018; Vargas et al 2019; Smedley et al 2022).
- Melanoma orale: il rilievo di 4 o più mitosi è associato a prognosi peggiore (sopravvivenza più breve) (sensibilità del 90% e specificità dell’84% - Bergin et al 2011, Camerino et al 2022).
- Melanoma cutaneo: un valore uguale o superiore a 3 è associato a sopravvivenza più breve (Laprie et al 2001; Smedley et al 2011; Lacroux et al 2012; Tsoi et al 2021; Silvestri et al 2018; Smedley et al 2022; Smedley et al 2022a).
- suggerito per il melanoma cutaneo delle aree con pelo un cut-off di 20/HPF (Laver et al 2018).
- Melanoma orale: l’invasione ossea (fino al 57% dei casi) è riportata come fattore prognostico negativo (Liptak 2020; Camerino et al 2022).
- Melanoma cutaneo: all’infiltrazione profonda corrisponderebbe un comportamento biologico-clinico più aggressivo (Laprie et al 2001).
- condiziona la necessità o meno di trattamenti adiuvanti per il controllo locale del melanoma (seconda chirurgia, radioterapia o elettrochemioterapia).
- a uno spessore superiore a 0,95cm si è associata sopravvivenza più breve e maggior rischio di decesso, se superiore a 0,75cm un periodo libero da malattia più breve (Silvestri et al 2018).
- Atipia nucleare: a 40 ingrandimenti, si contano da 100 a 200 cellule valutandole per il loro grado di differenziazione.
- Conta mitotica: si conta il numero di mitosi in un’area di 2,37 mm2 (equivalente a 10 campi a 40 ingrandimenti con oculare FN 22) (Laprie et al 2001; Esplin 2008; Smedley et al 2011; Lacroux et al 2012; Bongiovanni et al 2015; Silvestri et al 2018; Vargas et al 2019; Porcellato et al 2020; Prouteau et al 2020; Liu et al 2021; Porcellato et al 2021).
- Grado di pigmentazione: significato incerto.
- Livello di infiltrazione: non determinante ma di valore indicativo (Roels et al 1999; Laprie et al 2001; Proulx et al 2003).
- Invasione vascolare: implica, se presente, un peggioramento prognostico (Smith et al 2002). È comunque un parametro complementare.
- Valutazione dei margini di escissione
- Spessore del tumore (melanoma cutaneo) (Lacroux et al 2012; Silvestri et al 2018)
- Molecolari
- Melanoma orale: usando l’anticorpo specifico, si indica il numero medio di nuclei positivi in una griglia di 1 cm2 contati a 40 ingrandimenti nelle aree di maggior positività identificate a più basso ingrandimento; si valutano 5 campi della griglia (Bergin et al 2011; Smedley et al 2022).
- Un cut-off di 19,5 (19,5 nuclei positivi per area) assume valore prognostico maggiore rispetto a conta mitotica e atipia nucleare.
- Melanoma cutaneo: si conta il numero di nuclei positivi su 500 cellule a 40 ingrandimenti in una griglia di 1 cm2 e si riporta la percentuale di positività.
- La soglia del 15% discrimina melanomi a maggiore (>15%) o minore (<15%) aggressività clinica (Laprie et al 2001; Lacroux et al 2012).
- Ki-67: indice di proliferazione che indica la frazione tumorale in crescita (cellule in replicazione in qualsiasi fase del ciclo mitotico, a eccezione di quelle in quiescenza). È il parametro immunoistochimico più riproducibile (meno aspetti soggettivi) anche se possono risultare valori differenti da laboratori diversi. È importante sia per il melanoma orale e quello della giunzione mucocutanea sia per quello cutaneo (Laprie et al 2001; Bergin et al 2011; Smedley et al 2011; Lacroux et al 2012; Campagne et al 2013; Bongiovanni et al 2015; Iussich et al 2017; Piras et al 2017; Giacobino et al 2021; Camerino et al 2022; Smedley et al 2022; Smedley et al 2022a; Silva et al 2024).
MELANOMA ORALE DEL CANE
(mucosale intraorale e della giunzione muco-cutanea di labbra/guancia)
Fig. 2 - Melanoma orale
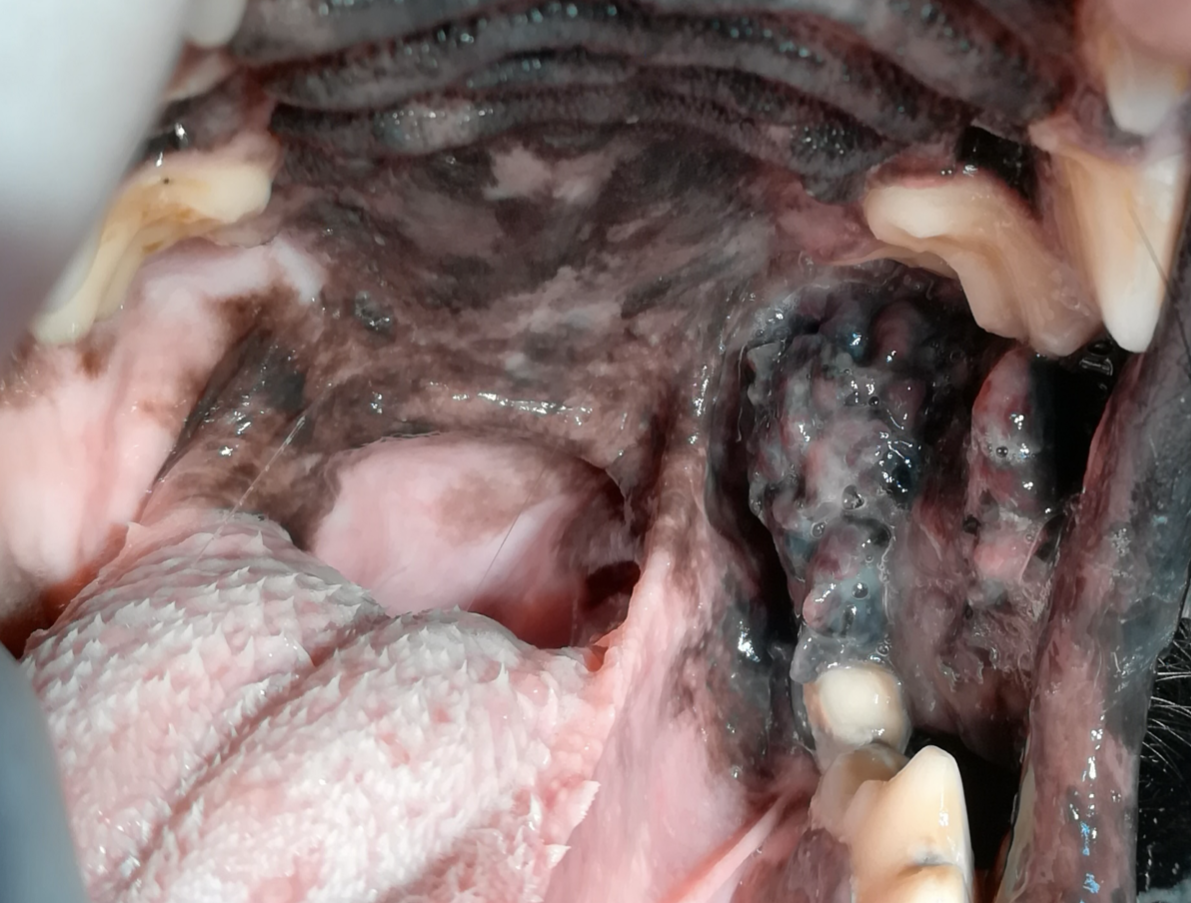
- È il più frequente tra i tumori orali del cane (fino al 40%).
- Predisposti i cani di piccola taglia e i soggetti con mucose pigmentate; razze più spesso colpite sono, oltre ai meticci, Cocker spaniel, Barboni, Pechinesi, Gordon setter, Chow Chow, Golden retriever e Bassotti (Ramos-Vara et al 2000).
- L’età media dei cani colpiti è 10,5-12 anni, ma ne possono essere affetti anche soggetti più giovani o più anziani.
- Più spesso localizzato a mucosa gengivale (42%), labbra/guancia (38%), palato (11%), lingua (7%, soprattutto terzo aborale) e tonsilla (1%). Le tonsille possono anche essere secondariamente colpite da metastasi in origine da melanomi escissi più rostralmente.
- Può essere melanotico, parzialmente melanotico o amelanotico (fino al 38% dei casi).
- È spesso sessile ma può anche presentarsi in forma peduncolata (soprattutto a livello di labbro/guancia ma anche in altre sedi). Anche se peduncolato, può essere caratterizzato da comportamento aggressivo e se ne sconsiglia l’asportazione senza margini adeguati.
- Sono in genere sintomatici (deformazione e/o sanguinamento, perdita localizzata di denti, e maleodoranti - alitosi) se di 3 cm o oltre.
- È maligno e aggressivo localmente, a rapida crescita; esiste comunque una piccola percentuale di melanomi orali o della giunzione muco-cutanea a comportamento meno aggressivo (Spangler and Kass 2006; Esplin et al 2008, Simpson et al 2014; Kim et al 2021; Smedley et al 2021; Di Palma et al 2021; Tsoi et al 2021; Smedley et al 2022; Smedley et al 2022a), la cui più limitata aggressività va confermata con la valutazione del Ki-67.
- Se gengivale, può invadere l’osso (fattore prognostico negativo - Camerino et al 2022). Se aborale è frequente l’invasione dello spazio retrobulbare; questo limita le possibilità di un’escissione chirurgica a margini non infiltrati.
Stadiazione
- Metastasi
- In cani con mucosa orale pigmentata, i linfonodi di interesse possono normalmente contenere melanociti, melanofagi o granuli di pigmento (Herring et al 2002; (Smith et al 2002).
- I regionali sono i linfonodi mandibolari (in numero variabile), ma nel 50% dei casi c’è possibilità di coinvolgimento di altri linfonodi (soprattutto i retrofaringei mediali [il linfocentro principale della regione] e, più raramente, i parotidei). Per tumori unilaterali la disseminazione può avvenire, nel 45-62% dei casi, anche a livello di linfonodi controlaterali (Herring et al 2002; Williams and Packer 2003; Skinner et al 2017; Grimes et al 2019; Randall et al 2020).
- Metastasi linfatiche sarebbero improbabili se il melanoma orale è meno di 6,5 mm di diametro e più probabili se di oltre 24,5 mm (Carroll et al 2020).
- Linfonodi metastatici in prima presentazione si rilevano fino al 54% dei casi (Giacobino et al 2021, Camerino et al 2022) ma questo dato può essere influenzato dalla procedura di linfadenectomia eseguita, con coinvolgimento linfonodale fino al 74% nel corso del follow-up post-trattamento.
- L’esame citologico può risultare negativo per metastasi se il linfonodo non è massivamente metastatico (Grimes et al 2017).
- Per l’identificazione dei linfonodi sentinella sia la TC standard sia la linfangiografia possono dare risultati incostanti (Skinner al 2018; Grimes et al 2020); in alcuni studi, comunque, i risultati sembrano più attendibili anche se non definitivi (Randall et al 2020; Goldschmidt et al 2023; Menghini et al 2023). Segnalato in uno studio anche l’uso della linfoscintigrafia (Randall et al 2020). Se disponibile, la PET/TC con fluorodesossiglucosio marcato (FDG) può identificare i linfonodi metastatici (sensibilità del 100% e specificità dell’83%) (Willcox et al 2021).
- L’escissione dei linfonodi sentinella/regionali ha l’obiettivo principale di definire il parametro N del TNM; non è chiaro se l’effetto possa essere anche terapeutico.
- Considerata la mancanza di consenso nei riguardi della linfadenectomia da eseguire (Congiusta et al 2020; Wainberg et al 2018) e in assenza e/o nell’impossibilità di identificazione certa dei linfonodi sentinella, le opzioni per la linfadenectomia contestuale alla rimozione del tumore primario possono prevedere l’escissione
- dei linfonodi mandibolari e retrofaringeo mediale ipsilaterali (Piras et al 2017; Giacobino et al 2021; Camerino et al 2022, Riccardo et al 2022)
- dei linfonodi mandibolari, parotideo e retrofaringeo mediale ipsilaterali (Odenweller et al 2019; Raleigh et al 2021)
- bilaterale dei linfonodi mandibolari e retrofaringei mediali (Green and Boston 2017, Piras et al 2017; Giacobino et al 2021; Camerino et al 2022; Riccardo et al 2022); considerata la rarità di metastasi al linfonodo parotideo, questa procedura è da considerarsi, al momento, ragionevole. Da segnalare la possibilità di un edema facciale che si protrae per un tempo variabile.
- Complessivamente (pre- e post-trattamento), polmoni e altre sedi (fegato, surrene, cuore, rene ed encefalo, etc.) sono colpiti fino al 92% dei casi (Liptak 2020)
- il melanoma mucocutaneo di labbra/guancia e quello della lingua sarebbero forse caratterizzati da comportamento clinico-biologico meno aggressivo (metastasi nel 29-45% dei casi)
- recidiva e/o malattia progressiva (metastasi linfatiche e/o distanti) rappresentano la causa del decesso nella maggior parte dei casi (Giacobino et al 2021, Camerino et al 2022).
- Linfonodi regionali/sentinella
- Polmoni e altre sedi
Staging clinico (TNM) modificato dei tumori della cavità orale del cane e del gatto (Owen 1980; Bergman et al. 2020) (Mucosa buccale, arcate dentali inferiore e superiore, palato duro, 2/3 anteriori della lingua, pavimento buccale)
-------------------------------------
T Tumore primario
Tis: tumore preinvasivo (in situ)
T1: tumore di meno di 2 cm di diametro, a: senza invasione ossea; b: con invasione ossea
T2: tumore di diametro compreso fra 2 e 4 cm, a: senza invasione ossea; b: con invasione ossea
T3: tumore di oltre 4 cm di diametro, a: senza invasione ossea; b: con invasione ossea
N: Linfonodi Regionali
N0 nessun segno di coinvolgimento
N1 evidenza citologica/istologica di coinvolgimento metastatico (precisare se ipsilaterali o bilaterali)
N2 linfonodi metastatici fissi (precisare se ipsilaterali o bilaterali)
M: Metastasi distanti
M0 nessuna evidenza di metastasi distanti
M1 evidenza di metastasi distanti
Stadi clinici
Stadio I T1 N0 M0
Stadio II T2 N0 M0
Stadio III T2 N1 M0
T3 N0 M0
Stadio IV Qualsiasi T Qualsiasi N M1
Trattamento
- Chirurgia en bloc (tumore primario) con l’intento, se possibile, di ottenere il controllo locale completo, e linfadenectomia regionale/sentinella (Culp et al 2013; Boston et al 2014; Tuohy et al 2014; Piras et al 2017; Giacobino et al 2021; Raleigh et al 2021; Camerino et al 2022; Riccardo et al 2022).
- L’osso va compreso nell’escissione en bloc se questo fa parte del margine calcolato di escissione anche quando questo non appare coinvolto.
- Chemioterapia adiuvante dose intensa (carboplatino): non dimostrato un significativo prolungamento della sopravvivenza (Rassnick et al 2001; Boria et al 2004; Dank et al 2014).
- Immunoterapia adiuvante: prolungamento della sopravvivenza se associata a chirurgia aggressiva (Bergman et al 2003 and 2006; Grosenbaugh et al 2011; McLean and Lobetti 2015; Piras et al 2017; Giacobino et al 2021; Camerino et al 2022; Riccardo et al 2022).
- Radioterapia: come adiuvante (Proulx et al 2003; Boston et al 2014; Kawabe et al 2015; Baja et al 2022) o come unico trattamento (anche come palliazione nei casi non operabili), in associazione o meno a chemioterapia (Freeman et al 2003; Murphy et al 2005; Kawabe et al 2015; Cancedda et al 2016; Noguchi et al 2022) o a immunoterapia (Turek et al 2020). Più efficace, in genere, in assenza di lisi ossea.
- Elettrochemioterapia: più efficace in assenza di erosione ossea (Tellado et al 2020; Moretti et al 2022); può associarsi a chirurgia citoriduttiva e terapia genica (Milevoj et al 2019; Nemec et al 2020).
- Palliazione
- Metronomica: come palliazione (Moretti et al 2022) e, empiricamente, come terapia di mantenimento.
- L’associazione di cisplatino (Boria et al 2004) o carboplatino (Brockley et al 2013) e piroxicam e la combinazione carboplatino e ciclofosfamide o clorambucile (Xia et al 2024) hanno dimostrato beneficio clinico in ambito palliativo.
- Riguardo l’impiego di anti-tirosinchinasici (Wouda et al 2018) sono necessari ulteriori studi. Il beneficio clinico sarebbe dovuto all’inibizione di recettori diversi da KIT, con esito in un possibile effetto antiangiogenico (Smedley et al 2021). Se usati come singolo agente non dimostrano spiccata attività clinica (Giuliano and Dobson 2020).
- Altre terapie: lupeolo (Yokoe et al 2015).
- Chemioterapia con sali del platino +/- Metronomica
- Radioterapia.
- Elettrochemioterapia.
Outcome
- Precedente chirurgia incompleta: se il ritardo di revisione chirurgica è di oltre 1 mese questo inciderebbe sulla sopravvivenza (Giacobino et al 2021); la disponibilità di fotografie della lesione originale può facilitare la pianificazione della revisione chirurgica dopo escissione incompleta.
- Solo chirurgia
- (stadi II-III): sopravvivenza mediana (SM) di 352 giorni (tasso di sopravvivenza a 1 anno del 29%) (Boston et al 2014)
- SM post-chirurgia di 17-18 mesi per melanomi di stadio I, di 5-6 mesi se di stadio II e di 3 mesi se di stadio III (Thuoy et al 2014).
- Chirurgia più vaccino adiuvante anti-tirosinasi umana: 111 cani, stadio II e III, SM non raggiunta rispetto a 324 giorni nei non vaccinati (Bergman et al 2003; Grosenbaugh et al 2011; McLean and Lobetti 2015). Risultati contrastanti sono stati riportati da alcuni autori (Ottnod et al 2013; Treggiari et al 2016, Verganti et al 2017; MacKenzie 2022).
- Chirurgia più vaccino anti-CSPG4 umano adiuvante (stadi II e III): tasso di sopravvivenza a 6, 12, 18, 24 mesi rispettivamente del 95,6%, 73,9%, 47,8%, 30,4% (SM di 684 giorni). Risultati analoghi sono stati recentemente ottenuti utilizzando il plasmide chimerico umano-canino CSPG4-HuDo (Piras et al 2017; Giacobino et al 2021; Camerino et al 2022; Riccardo et al 2022).
- Radioterapia ipofrazionata: lo stadio clinico influenza il periodo libero da progressione e la sopravvivenza; possibile associare terapia metronomica (Freeman et al 2003; Proulx et al 2003; Murphy et al 2005; Boston et al 2014; Kawabe et al 2015; Baja et al 2022; Cancedda et al 2016; Noguchi et al 2022) o immunoterapia (Turek et al 2020).
- In uno studio relativo a 111 melanomi orali irradiati +/- altre terapie la SM è stata di 758 giorni per i melanomi di stadio I, 278 giorni se di stadio II, 163 giorni se di stadio III e 80 giorni se di stadio IV (differenza significativa fra stadio I vs. stadio IV); effetti collaterali gravi sono stati riportati in 9 cani (Kawabe et al 2015);
- in un ulteriore studio su 101 melanomi orali la mediana del tempo libero da progressione e SM sono state rispettivamente di 171 e di 232 giorni (Baja et al 2022).
- Elettrochemioterapia palliativa (unico trattamento, 67 cani) (Tellado et al 2020): risposta locale nel 100% dei melanomi di stadio I, 89,5% se di stadio II, 57,7% se di stadio III, e 36,4% se di stadio IV. Solo negli stadi I-III con risposta parziale o completa si è assistito a miglioramento della qualità di vita.
- Tempo mediano di progressione: 11 mesi per i melanomi di stadio I, 7 mesi se di stadio II e 4 mesi per gli stadi III e IV; SM di 16,5 mesi se di stadio I, 9 mesi se di stadio II, 7,5 mesi se di stadio III e 4,5 mesi se di stadio IV; risultati migliori osservati negli stadi I e II, senza invasione ossea.
MELANOMA CUTANEO DEL CANE
Melanoma a insorgenza in aree con pelo (compreso spazio interdigitale)
Fig. 3 - Melanoma cutaneo
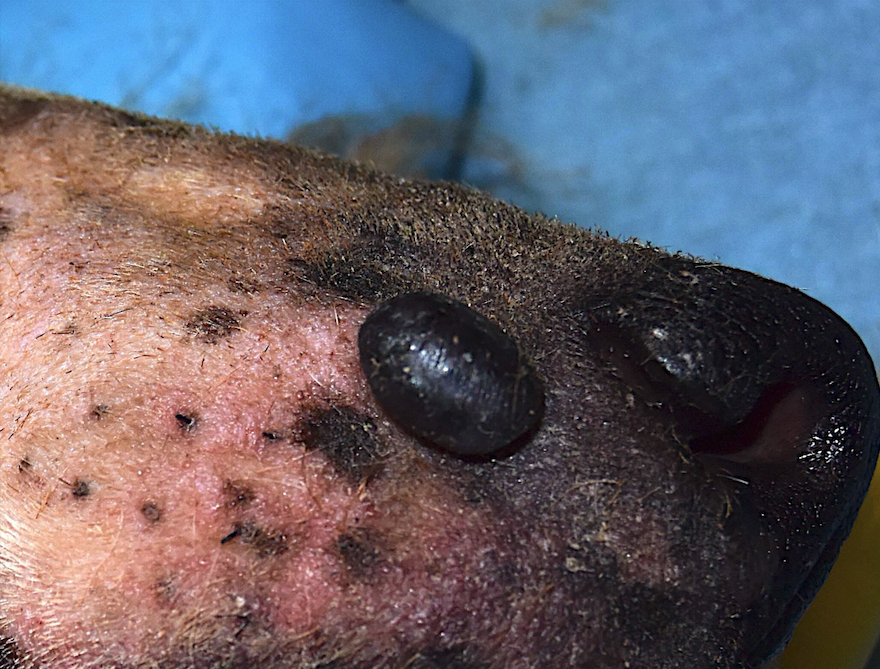
- Il melanocitoma incide per il 3-4% dei tumori cutanei del cane, le forme maligne per l’1-2%.
- Più colpiti i cani a mantello scuro, in genere di età media di oltre 7 anni.
- Il melanocitoma è in genere singolo, ben definito, alopecico, di non oltre 1 cm e pigmentato; può essere eventualmente multiplo nel setter irlandese e nel doberman.
- Il melanoma maligno è caratterizzato da pigmentazione variabile, può ulcerarsi e infiltrare i tessuti circostanti ed è in genere di oltre 2,5 cm; utile l’immunoistochimica per identificare le forme amelanotiche.
- Metastasi di melanoma delle aree cutanee con pelo, in uno studio relativo a 87 casi, sono state rilevate in presentazione nell’11,9% dei casi (5 su 42 cani esaminati) a livello dei linfonodi regionali e nel 3,7% dei casi a livello polmonare (3 su 82 cani valutati) (Laver et al 2018).
- L’apparente minor aggressività di questo istotipo è comunque da confermare/escludere a seguito della valutazione dei diversi fattori prognostici istologici e immunoistochimici.
- Escissione ampia, con adeguato margine periferico e profondo e linfadenectomia (come minimo regionale).
Outcome (Laver et al 2018)
- Studio su 87 cani: 29 cani ancora vivi al termine dell’arruolamento e 20 persi nel follow-up ma senza evidenza di recidiva e/o metastasi all’ultimo controllo.
- SM dell’intera popolazione di 87 cani: 1363 giorni (27-3246).
- Fattori prognostici negativi
- età > 9,4 anni
- conta mitotica >20/10 HPF (diminuzione della sopravvivenza con differenza significativa); >17/10HPF (diminuzione del periodo libero da malattia). Questo dato metterebbe in discussione il tradizionale cut-off di 3 indicato per questo istotipo, come anche sottolineato da Schultheiss et al (2006).
- Mediana del periodo libero da malattia dell’intera popolazione (87 cani): 1282 giorni (27-3246)
- Tasso di recidiva del 8% (7 su 87).
- Metastasi post-chirurgia nel 21,8% (19 su 87; metastasi ai linfonodi regionali in 4 su 87).
- La chirurgia come unico presidio appare sufficiente nella maggior parte dei casi. Anche in caso di melanoma con conta mitotica >20/HPF sia la sopravvivenza mediana sia il periodo mediano libero da malattia sono apparsi protratti; questo mette in discussione l’opportunità di qualsiasi terapia adiuvante.
- Malattia progressiva (altri melanomi cutanei in sedi distanti) in 5 cani.
- SM di 1363 giorni (107-1484) per il melanoma digitale in aree con pelo (16 casi) vs. SM di 1584 giorni (27-3246) per il melanoma di altre sedi con pelo
- mediana del periodo libero da malattia di 797 giorni (87-1484) vs. 1282 giorni (27-3246);
- differenza non significativa;
- quindi: il melanoma digitale delle aree con pelo sarebbe caratterizzato da prognosi simile alle altre localizzazioni di melanoma cutaneo di aree non glabre, a differenza di quanto segnalato in precedenza (Marino et al 1995; Spangler and Kass 2006; Schultheiss et al 2006).
Melanoma digitale/ungueale
- È il secondo tumore ungueale più frequente (dopo carcinoma squamoso); ne sarebbe predisposto lo Scottish terrier.
- Più spesso rilevabile in cani a mantello scuro ma non esclusivamente.
- I soggetti colpiti sono in genere anziani (di oltre 10 anni); si sospetta una predisposizione nelle femmine (Wobeser et al 2007).
- Necessaria la stadiazione completa, includendo anche la valutazione radiografica delle dita per confermare o meno l’erosione ossea (che potrebbe avere significato prognostico).
- Metastasi a linfonodi regionali e/o a sedi distanti in prima presentazione incidono per il 30-40%; dopo trattamento, metastasi possono poi svilupparsi in un ulteriore 10-26% dei cani (Marino et al 1995; Henry et al 2005).
- Richiede amputazione alta, come minimo a livello metacarpo/metatarso-falangea, e linfadenectomia (regionale o sentinella – se la mappatura è stata eseguita).
Outcome
- Dopo solo chirurgia: tasso di sopravvivenza a 1 anno del 42-57% e del 13-36% a 2 anni; SM di circa 12 mesi (Marino et al 1995; Wobseser et al 2007; Aronshon and Carpenter 1990; Henry et al 2005; Schultheiss 2006).
- Chemioterapia e immunoterapia adiuvanti non sembrano migliorare la prognosi in modo significativo (Brockely et al 2013) (tasso di sopravvivenza a 1 anno del 63% e a 2 anni del 32%, SM di 476 giorni) (Manley et al 2011).
Melanoma del polpastrello (Jeon et al 2022)
- Colpisce animali anziani (età mediana di 10,5 anni, 5,2-15), di taglia grande (peso mediano di 31,7 kg, 7-42).
- Razze segnalate: Labrador, Schnauzer (di ogni taglia), spaniels, flat-coated retriever, bulldog francese, Norwich terrier, rottweiler e meticcio.
- Soprattutto colpito il polpastrello principale; spesso si rileva ulcerazione (65%).
- Necessaria stadiazione completa, includendo anche la valutazione radiografica della parte distale dell’arto per confermare o meno l’erosione ossea (che potrebbe avere significato prognostico).
- Metastasi ai linfonodi regionali in prima presentazione in 4 su 20 (20%); in nessun cane sono state rilevate metastasi lontane.
- Conta mitotica media di 10/10HPF (1-48).
- Escissione en bloc (se possibile) o amputazione dell’arto, e linfadenectomia (regionale o sentinella – se eseguita mappatura).
Outcome (Jeon et al 2022)
- Report relativo a 20 cani.
- Chirurgia: margini di escissione non infiltrati in 7 casi, più ulteriori 4 di 5 casi in cui è stata effettuata revisione chirurgica.
- Trattamenti adiuvanti vari: chemioterapia con vari agenti (compresi gli anti-tirosinchinasici), vaccinoterapia e radioterapia.
- Dieci cani non considerati nella valutazione del tempo libero da malattia (4 vivi al termine dell’arruolamento senza evidenza di recidiva e/o metastasi, 3 persi nel follow-up e 3 deceduti)
- Tempo mediano di follow-up: 328 giorni (155–1118 days).
- Dieci cani (50%) hanno sviluppato malattia progressiva (recidiva, metastasi linfatiche o distanti)
- Otto cani non sono stati considerati per il calcolo della sopravvivenza (5 cani ancora vivi e 3 persi nel follow-up); tempo mediano di follow-up 557 giorni (155-690).
- SM generale di 240 giorni (25-479).
- SM correlata al melanoma di 203 giorni (23-387).
- SM nei cani che hanno ricevuto trattamento adiuvante pari a 159 giorni (25-387).
- I casi sono pochi e i trattamenti sono stati vari. L’unica possibile conclusione è che il melanoma del polpastrello può essere caratterizzato da comportamento clinico-biologico aggressivo. Questo implica stadiazione accurata e corretta pianificazione della chirurgia (escissione ad ampio margine del primario, linfadenectomia del/i linfonodo/i regionale o del sentinella – se la mappatura è stata eseguita) e terapie adiuvanti dipendenti da esame istologico e valutazione dei fattori prognostici clinici e di laboratorio.
MELANOMA DI SEDI MENO COMUNI (pochi dati desumibili da letteratura)
Melanoma delle giunzioni mucocutanee
- Presumibilmente aggressivo.
- Opportuna la stadiazione completa.
- Basarsi su fattori prognostici come per il melanoma di cavo orale/giunzione mucocutanea di labbra e guancia.
- Trattamento comprendente chirurgia en bloc (più linfadenectomia del linfonodo sentinella – se eseguita mappatura - o del regionale) e terapia adiuvante (come per cavo orale/giunzione mucocutanea di labbra e guancia) in caso di forme aggressive accertate.
Melanoma della regione anale/perianale/anorettale
- Origine spesso non chiara ma è sospettabile che in molti casi derivi dal seno paranale (Kim et al 2005; Clarke and Rissi 2018).
- Stadiazione completa (con eventuale mappatura dei linfonodi).
- Chirurgia en bloc e linfadenectomia (+/- radioterapia).
- Riportata palliazione con elettrochemioterapia (Spugnini et al 2007).
Melanoma del seno paranale (Vinayak et al 2017)
- Report relativo a 11 cani.
- Chirurgia in 8 (di cui 3 hanno ricevuto vaccinoterapia adiuvante e 1 chemioterapia adiuvante), solo chemioterapia in 1 e palliazione sintomatica in 2.
- SM di 107 giorni; 10 cani su 11 sono stati sottoposti a eutanasia per progressione locale o distante; solo 1 cane vivo a 1 anno dalla diagnosi (stessa esperienza degli autori).
Melanoma endonasale (Davies et al 2017)
- Report relativo a 3 cani
- Palliazione con radioterapia
- Remissione completa per 5 mesi (poi decesso per cause non correlate) in un cane e per 7 mesi in un secondo soggetto (eutanasia dopo 13 mesi dalla diagnosi per convulsioni); malattia stabile per 4 mesi nel terzo cane (controllo dei segni clinici per 10 mesi poi perso nel follow-up a 1 anno dalla diagnosi).
Melanoma del tartufo
- Occasionale; l’aggressività clinica è da verificare clinicamente e mediante valutazione dei parametri istologici e immunoistochmici.
- Stadiazione completa.
- Escissione en bloc e linfadenectomia regionale o del linfonodo sentinella (dopo mappatura).
Melanoma oculare/periorbitale (Miller and Teixeira 2020)
- Congiuntivale
- In cani con congiuntiva palpebrale pigmentata, potenzialmente anche a livello della nittitante.
- Forse predisposizione in cani anziani (età media di 11 anni), femmine, di razze medio-grandi (soprattutto Weimaraner e forse Pastore tedesco).
- Comportamento maligno locale (recidiva e metastasi ai linfonodi regionali) piuttosto che sistemico.
- Fattori prognostici non chiari.
- Epibulbare
- In cani di 5-6 anni, soprattutto femmine; forse predisposizione nel Pastore tedesco, Labrador e Golden retriever.
- In genere benigno e localizzato dorsalmente.
- L’escissione parziale può essere seguita da recidiva.
- Uveale
- Camera anteriore
- Più spesso in cani di oltre 7 anni.
- 95% da iride o corpi ciliari.
- 75% è benigno (diagnosi post-enucleazione).
- Consigliabile la monitorizzazione periodica per escludere progressione e decidere per ulteriore trattamento, se opportuno.
- Tasso metastatico dal 4% fino al 25% (anche dopo enucleazione).
- Camera anteriore
- Coroide
- Cani di 6-7 anni, più spesso di taglia media e grande.
- Benigno nella maggior parte dei casi.
- Può invadere l’orbita; in questo caso la prognosi è più incerta.
Bibliografia suggerita
- Aronsohn MG and Carpenter JL. Distal extremity melanocytic nevi and malignant melanoma in dogs, J Am Anim Hosp Assoc 26:605– 612, 1990.
- Baja AJ, Kelsey KL, Ruslander DM, Gieger TL, Nolan MW. A retrospective study of 101 dogs with oral melanoma treated with a weekly or biweekly 6 Gy × 6 radiotherapy protocol. Vet Comp Oncol 20(3):623-631, 2022.
- Bergin IL, Smedley RC, Esplin DG, Spangler WL, Kiupel M. Prognostic Evaluation of Ki67 Threshold Value in Canine Oral Melanoma. Vet Pathol 48:41–53, 2011.
- Bergman PJ, McKnight J, Novosad A, Charney S, Farrelly J, Craft D, Wulderk M, Jeffers Y, Sadelain M, Hohenhaus AE, Segal N, Gregor P, Engelhorn M, Riviere I, Houghton AN, Wollhok JD. Long-term survival of dogs with advanced malignant melanoma after DNA vaccination with xenogeneic human tyrosinase: a phase I trial. Clin Cancer Res 9:1284-1290, 2003.
- Bergman PJ, Camps-Palau MA, McKnight JA, Leibman NF, Craft DM, Leung C, Liao J, Riviere I, Sadelain M, Hohenhaus AE, Gregor P, Houghton AN, Perales MA, Wolchok JD. Development of a xenogeneic DNA vaccine program for canine malignant melanoma at the Animal Medical Center. Vaccine 24(21):4582-5, 2006.
- Bergman PJ, Selmic LE, Kent MS. Melanoma. In: Vail DM, Thamm DH, Liptak JM, eds. Withrow and Mac Ewen's Small Animal Clinical Oncology. 6th ed. St. Louis: Elsevier, pp. 367-381, 2020.
- Bongiovanni L, D’Andrea A, Porcellato I, Ciccarelli A, Malatesta D, Romanucci M, Della Salda L, Mechelli L, Brachelente C. Canine cutaneous melanocytic tumours: Significance of beta-catenin and survivin immunohistochemical expression. Vet Dermatol 26: 270-e59, 2015.
- Boria PA, Murry DJ, Bennett PF, Glickman NW, Snyder PW, Merkel BL, Schlittler DL, Mutsaers AJ, Thomas RM, Knapp DW. Evaluation of cisplatin combined with piroxicam for the treatment of oral malignant melanoma and oral squamous cell carcinoma in dogs. J Am Vet Med Assoc 224(3):388-394, 2004.
- Boston SE, Lu X, Culp WT, Montinaro V, Romanelli G, Dudley RM, Liptak JM, Mestrinho LA, Buracco P. Efficacy of systemic adjuvant therapies administered to dogs after excision of oral malignant melanomas: 151 cases (2001–2012). J Am Vet Med Assoc 245(4):401-407, 2014.
- Brockley LK, Cooper MA, Bennett PF. Malignant melanoma in 63 dogs (2001–2011): the effect of carboplatin chemotherapy on survival. N Z Vet J 61(1):25-31, 2013.
- Camerino M, Giacobino D, Manassero L, Iussich S, Riccardo F, Cavallo F, Tarone L, Olimpo M, Lardone E, Martano M, et al. Prognostic impact of bone invasion in canine oral malignant melanoma treated by surgery and anti-CSPG4 vaccination: A retrospective study on 68 cases (2010–2020). Vet Comp Oncol 20: 189–197, 2022.
- Campagne C, Julé S, Alleaume C, Bernex F, Ezagal J, Château-Joubert S, Estrada M, Aubin-Houzelstein G, Panthier J-J, Egidy G. Canine Melanoma Diagnosis: RACK1 as a potential biological marker. Vet. Pathol 50:1083–1090, 2013.
- Cancedda S, Rohrer Bley C, Aresu L, Dacasto M, Leone VF, Pizzoni S, Gracis M, Marconato L. Efficacy and side effects of radiation therapy in comparison with radiation therapy and temozolomide in the treatment of measurable canine malignant melanoma. Vet Comp Oncol 14(4):e146-e115, 2016.
- Carroll KA, Kuntz CA, Heller J, Peters A, Rotne R, Dunn A. Tumor size as predictor of lymphatic invasion in oral melanomas in dogs. J Am Vet Med Assoc 2020 256(10):1123-1128, 2020.
- Clarke LL, Rissi DR. Malignant rectal melanoma in 2 dogs. Can Vet J 59(2):152-154, 2018.
- Congiusta M, Lawrence J, Rendahl A, Goldschmidt S. Variability in Recommendations for Cervical Lymph Node Pathology for Staging of Canine Oral Neoplasia: A Survey Study. Front Vet Sci 7, 506, 2020.
- Culp WT, Ehrhart N, Withrow SJ, Rebhun RB, Boston S, Buracco P, Reiter AM, Schallberger SP, Aldridge CF, Kent MS, Mayhew PD, Brown DC. Results of surgical excision and evaluation of factors associated with survival time in dogs with lingual neoplasia: 97 cases (1995–2008). J Am Vet Med Assoc 242:1392-1397, 2013.
- Dank G, Rassnick KM, Sokolovsky Y, Garret LD, Post GS, Kitchell BE, Sellon RK, Kleiter M, Northrup N, Segev G. Use of adjuvant carboplatin for treatment of dogs with oral malignant melanoma following surgical excision. Vet Comp Oncol 12(1):78-84, 2014.
- Davies O, Spencer S, Necova S, Holmes E, Taylor A, Blackwood L, Lara-Garcia A. Intranasal melanoma treated with radiation therapy in three dogs. Vet Q 37(1):274-281, 2017.
- Di Palma S, McConnell A, Verganti S, Starkey M. Review on Canine Oral Melanoma: An Undervalued Authentic Genetic Model of Human Oral Melanoma? Vet Pathol 58(5):881-889, 2021.
- Esplin DG. Survival of Dogs Following Surgical Excision of Histologically Well-differentiated Melanocytic Neoplasms of the Mucous Membranes of the Lips and Oral Cavity. Vet Pathol 45: 889–896, 2008.
- Freeman KP, Hahn KA, Harris FD, King GK. Treatment of dogs with oral melanoma by hypofractionated radiation therapy and platinum-based chemotherapy (1987–1997). J Vet Intern Med 17: 96-101, 2003.
- Giacobino D, Camerino M, Riccardo F, Cavallo F, Tarone L, Martano M, Dentini A, Iussich S, Lardone E, Franci P, Valazza A, Manassero L, Del Magno S, De Maria R, Morello E, Buracco P. Difference in outcome between curative intent vs marginal excision as a first treatment in dogs with oral malignant melanoma and the impact of adjuvant CSPG4-DNA electrovaccination: A retrospective study on 155 cases. Vet Comp Oncol 19(4):651-660, 2021.
- Giuliano A and Dobson J. Prospective clinical trial of masitinib mesylate treatment for advanced stage III and IV canine malignant melanoma. J Small Anim Pract 61(3):190-194, 2020.
- Goldschmidt S, Stewart N, Ober C, Bell C, Wolf-Ringwall A, Kent M, Lawrence J. Contrast-enhanced and indirect computed tomography lymphangiography accurately identifies the cervical lymphocenter at risk for metastasis in pet dogs with spontaneously occurring oral neoplasia. PLoS One 18(3):e0282500, 2023.
- Goldschmidt S, Stewart N, Ober C, Bell C, Wolf-Ringwall A, Kent M, Lawrence J. Contrast-enhanced and indirect computed tomography lymphangiography accurately identifies the cervical lymphocenter at risk for metastasis in pet dogs with spontaneously occurring oral neoplasia. Plos One 18(3):e02282500, 2023.
- Green K and Boston SE. Bilateral removal of the mandibular and medial retropharyngeal lymph nodes through a single ventral midline incision for staging of head and neck cancers in dogs: a description of surgical technique. Vet Comp Oncol 15(1):208-214, 2017.
- Grimes JA, Matz BM, Christopherson PW, Koehler JW, Cappelle KK, Hlusko KC, Smith A. Agreement Between Cytology and Histopathology for Regional Lymph Node Metastasis in Dogs with Melanocytic Neoplasms. Vet Pathol 54:579–587, 2017.
- Grimes JA, Mestrinho LA, Berg J, Cass S, Oblak ML, Murphy S, Amsellem PM, Brown P, Hamaide A, Matz .M Histologic evaluation of mandibular and medial retropharyngeal lymph nodes during staging of oral malignant melanoma and squamous cell carcinoma in dogs. J Am Vet Med Assoc 254:938–943, 2019.
- Grimes JA, Secrest SA, Wallace ML, Laver T, Schmiedt CW. Use of indirect computed tomography lymphangiography to determine metastatic status of sentinel lymph nodes in dogs with a pre-operative diagnosis of melanoma or mast cell tumour. Vet Comp Oncol 18:818–824, 2020.
- Grosenbaugh DA, Leard AT, Bergman PJ, Klein MK, Meleo K, Susanek S, Hess PR, Jankowski MK, Jones PD, Leibman NF, Johnson MH, Kurzman ID, Wolcock JD. Safety and efficacy of a xenogeneic DNA vaccine encoding for human tyrosinase as adjunctive treatment for oral malignant melanoma in dogs following surgical excision of the primary tumor. Am J Vet Res 72:1631-1638, 2011.
- Henry CJ, Brewer WG, Whitley EM, Tyler JW, Ogilvie GK, Norris A, Fox LE, Morison WB, Hammer A, Vail DM, Berg J; Veterinary Cooperative Oncology Group (VCOG). Canine digital tumors: a veterinary cooperative oncology group retrospective study of 64 dogs. J Vet Intern Med 19:720–724, 2005.
- Herring ES, Smith MM, Robertson JL. Lymph Node Staging of Oral and Maxillofacial Neoplasms in 31 Dogs and Cats. J Vet Dent 19:122–126, 2002.
- Iussich S, Maniscalco L, Di Sciuva A, Iotti B, Morello E, Martano M, Gattino F, Buracco P, De Maria R. PDGFRs expression in dogs affected by malignant oral melanomas: Correlation with prognosis. Vet Comp Oncol 15:462–469, 2017.
- Jeon MD, Leeper HJ, Cook MR, McMillan SK, Bennet T, Murray CA, Tripp CD, Curran KM. Multi-institutional retrospective study of canine foot pad malignant melanomas: 20 cases. Vet Comp Oncol 20(4):854-861, 2022.
- Kawabe M, Mori T, Ito Y, Murakami M, Sakai H, Yanai T, Maruo K. Outcomes of dogs undergoing radiotherapy for treatment of oral malignant melanoma: 111 cases (2006–2012). J Am Vet Med Assoc 247:1146-1153, 2015.
- Kim DY, Mauldin GE, Hosgood G, Cho D-Y. Perianal malignant melanoma in a dog. J Vet Intern Med 19:610 – 612, 2005.
- Kim WS, Vinayak A, Powers B. Comparative Review of Malignant Melanoma and Histologically Well-Differentiated Melanocytic Neoplasm in the Oral Cavity of Dogs. Vet Sci 8(11):261, 2021.
- Lacroux C, Raymond-Letron I, Bourges-Abella N, Lucas MN, Deviers A, Serra F, Degorce-Rubiales F, Delverdier M. Study of canine cutaneous melanocytic tumours: Evaluation of histological and immunohistochemical prognostic criteria in 65 cases. Rev Med Vet 163:393–401, 2012.
- Laprie C, Abadie J, Amardeilh M, Net J, Lagadic M, Delverdier M. MIB-1 immunoreactivity correlates with biologic behaviour in canine cutaneous melanoma. Vet Dermatol 12:139–147, 2001.
- Laver T, Feldhaeusser BR, Robat CS, Baez JL, Cronin KL, Buracco P, Annoni M, Regan RC,McMillan SK, Curran KM et al. Post-surgical outcome and prognostic factors in canine malignant melanomas of the haired skin: 87 cases (2003–2015). Can Vet J 59, 981–987, 2018.
- Liptak JM. Oral tumors. In: Vail DM, Thamm DH, Liptak JM, eds., Withrow and MacEwen's Small Animal Clinical Oncology. 6th edition, St. Louis, MO: Elsevier, pp. 432-448, 2020.
- Liu I, Chung TF, Huang WH, Hsu CH, Liu CC, Chiu YH, Huang KC, Liao AT, Lin CS. Kynurenine 3-monooxygenase (KMO), and signal transducer and activator of transcription 3 (STAT3) expression is involved in tumour proliferation and predicts poor survival in canine melanoma. Vet Comp Oncol 19:79–91, 2021.
- MacKenzie AP. The Use of Oncept Melanoma Vaccine in Veterinary Patients: A Review of the Literature. Vet Sci 9(11):597, 2022.
- Manley CA, Leibman NF, Wolchok JD, Riviére IC, Bartido S, Craft DM, Bergman PJ. Xenogeneic murine tyrosinase DNA vaccine for malignant melanoma of the digit of dogs. J Vet Intern Med 25:94–99, 2011.
- Marino DJ, Matthiesen DT, Stefanacci JD, Moroff SD. Evaluation of dogs with digit masses: 117 cases (1981-1991). J Am Vet Med Assoc 207(6):726-8, 1995.
- McLean JL, Lobetti RG. Use of the melanoma vaccine in 38 dogs: 2015; the South African experience. J S Af Vet Ass 86:1246, 2015.
- Menghini TL, Schwarz T, Dancer S, Gray C, MacGillivray T, Bowlt Blacklock KL. Contrast-enhanced CT predictors of lymph nodal metastasis in dogs with oral melanoma. Vet Radiol Ultrasound 64(4):694-705, 2023.
- Milevoj N, Tratar UL, Nemec A, Brozic A, Znidar K, Serša G, Čemažar M, Tozon N. A combination of electrochemotherapy, gene electrotransfer of plasmid encoding canine IL-12 and cytoreductive surgery in the treatment of canine oral malignant melanoma. Res Vet Sci 122:40-49, 2019.
- Miller PE and Teixeira LBV. Ocular tumors. In: Vail DM, Thamm DH, Liptak JM, eds., Withrow and MacEwen's Small Animal Clinical Oncology. 6th edition, St. Louis, MO: Elsevier, pp. 675-687, 2020.
- Moretti G, Dentini A, Beccati F, Arcelli R, Di Matteo I, Giovannini G, Bufalari A. Palliative repeated electroporations of oral tumours in dogs: A case series. Front Vet Sci 9:1004811, 2022.
- Murphy S, Hayes AM, Blackwood L, Maglennon G, Pattinson H, Sparkes AH. Oral malignant melanoma - the effect of coarse fractionation radiotherapy alone or with adjuvant carboplatin therapy. Vet Comp Oncol 3(4):222-229, 2005.
- Nemec A, Milevoj N, Lampreht Tratar U, Serša G, Čemažar M, Tozon N. Electroporation-Based Treatments in Small Animal Veterinary Oral and Maxillofacial Oncology. Front Vet Sci 7:575911, 2020.
- Noguchi S, Yagi K, Okamoto N, Wada Y, Tanaka T. Prognostic Factors for the Efficiency of Radiation Therapy in Dogs with Oral Melanoma: A Pilot Study of Hypoxia in Intraosseous Lesions. Vet Sci 10(1):4, 2022.
- Odenweller PH, Smith MM, Taney KG. Validation of Regional Lymph Node Excisional Biopsy for Staging Oral and Maxillofacial Malignant Neoplasms in 97 Dogs and 10 Cats (2006-2016). J Vet Dent 36(2):97-103, 2019.
- Ottnod JM, Smedley RC, Walshaw R, Hauptman JG, Kiupel M, Obradovich JE. A retrospective analysis of the efficacy of Oncept vaccine for the adjunct treatment of canine oral malignant melanoma. Vet Comp Oncol 11:219-229, 2013.
- Owen LN, ed. World Health Organization TNM Classification of Tumors in Domestic Animals. 1st. ed. Geneva, WHO; Veterinary Public Health Unit & WHO Collaborating Center for Comparative Oncology, 1980.
- Piras LA, Riccardo F, Iussich S, Maniscalco L, Gattino F, Martano M, Morello E, Lora Mayayo S, Rolih V, Garavaglia F, De Maria R, Lardone E, Collivignarelli F, Mignacca D, Giacobino D, Ferrone S, Cacallo F, Buracco P. Prolongation of survival of dogs with oral malignant melanoma treated by en bloc surgical resection and adjuvant CSPG4-antigen. Vet Comp Oncol 15(3):996-1013, 2017.
- Porcellato I, Silvestri S, Menchetti L, Mechelli L, Sforna M, Iussich S, Bongiovanni L, Lepri E, Brachelente C. Tumour-infiltrating lymphocytes in canine melanocytic tumours: An investigation on the prognostic role of CD3+ and CD20 + lymphocytic populations. Vet Comp Oncol 18:370–380, 2020.
- Porcellato IL, Brachelente C, Cappelli K, Menchetti, L, Silvestri S, Sforna M, Mecocci S, Iussich S, Leonardi L, Mechelli L. FoxP3, CTLA-4, and IDO in Canine Melanocytic Tumors. Vet Pathol 58:42–52, 2021.
- Prouteau A, Chocteau F, De Brito C, Cadieu E, Primot A, Botherel N, Degorce F, Cornevin L, Lagadic MA, Cabillic F, et al. Prognostic value of somatic focal amplifications on chromosome 30 in canine oral melanoma. Vet Comp Oncol 18:214–223, 2020.
- Proulx DR, Ruslander DM, Dodge RK, Hauck ML, Williams LE, Horn B, Price GS, Thrall DE. Retrospective Analysis of 140 Dogs with Oral Melanoma Treated with External Beam Radiation. Vet Radiol Ultrasound 44:352–359, 2003.
- Przeździecki R, Czopowicz M, Sapierzyński R. Accuracy of routine cytology and immunocytochemistry in preoperative diagnosis of oral amelanotic melanomas in dogs. Vet Clin Pathol 44:597–604, 2015.
- Raleigh ML, Smith MM, Taney K. Curative Intent Surgery of Oral Malignant Melanoma and Regional Lymph Node Biopsy Assessment in 25 Dogs: 2006-2017. J Vet Dent 38(4):193-198, 2021.
- Ramos-Vara JA, Beissenherz ME, Miller MA, Johnson GC, Pace LW, Fard A, Kottler SJ. Retrospective study of 338 canine oral melanomas with clinical, histologic, and immunohistochemical review of 129 cases. Vet Pathol 37: 597-608, 2000.
- Randall EK, Jones MD, Kraft SL, Worley DR. The development of an indirect computed tomography lymphography protocol for sentinel lymph node detection in head and neck cancer and comparison to other sentinel lymph node mapping techniques. Vet Comp Oncol 18(4):634-644, 2020.
- Rassnick KM, Ruslander DM, Cotter SM, Al-Sarraf R, Bruyette DS, Gamblin RM, Meleo KA, Moore AS. et al. Use of carboplatin for treatment of dogs with malignant melanoma: 27 cases (1989–2000). J Am Vet Med Assoc 218(9):1444-1448, 2001.
- Riccardo F, Tarone L, Camerino MT, Giacobino D, Iussich S, Barutello G, Arigoni M, Conti L, Bolli E, Quaglino E, Merighi IF, Morello E, Dentini A, Ferrone S, Buracco P, Cavallo F. Antigen mimicry as an effective strategy to induce CSPG4-targeted immunity in dogs with oral melanoma: a veterinary trial. J Immunother Cancer 10(5):e004007, 2022.
- Roels S, Tilmant K, Ducatelle R. PCNA and Ki67 Proliferation Markers as Criteria for Prediction of Clinical Behaviour of Melanocytic Tumours in Cats and Dogs. J Comp Pathol 121:13–24, 1999.
- Schultheiss PC. Histologic features and clinical outcomes of melanomas of lip, haired skin, and nail bed locations of dogs. J Vet Diagn Invest 18:422–425, 2006.
- Silvestri S, Porcellato I, Mechelli L, Menchetti L, Rapastella S, Brachelente C. Tumor Thickness and Modified Clark Level in Canine Cutaneous Melanocytic Tumors. Vet Pathol 56:180–188, 2018.
- Silva ML, Martinho I, Rocha M, Martano M, Spindler KP, Buracco P, Giacobino D, Florindo HF, Mestrinho LA. Relative Tumour Volume in Canine Oral Melanoma Staging and Prognosis. Veterinary and Comparative Oncology, 2024; 0:1–10 https://doi.org/10.1111/vco.13018
- Simpson RM, Bastian B, Michael H, Webster JD, Prasad ML, Conway CM, Prieto VM, Gary JM, Goldschmidt M, Esplin DG, et al. Sporadic naturally occurring melanoma in dogs as a preclinical model for human melanoma. Pigment Cell Melanoma Res 27:37–47, 2014.
- Skinner O.T, Boston SE, Souza CHDM. Patterns of lymph node metastasis identified following bilateral mandibular and medial retropharyngeal lymphadenectomy in 31 dogs with malignancies of the head. Vet Comp Oncol 15:881–889, 2017.
- Skinner OT, Boston SE, Giglio RF, Whitley EM, Colee JC, Porter EG. Diagnostic accuracy of contrast-enhanced computed tomography for assessment of mandibular and medial retropharyngeal lymph node metastasis in dogs with oral and nasal cancer. Vet Comp Oncol 16(4):562-570, 2018.
- Smedley RC, Spangler WL, Esplin DG, Kitchell BE, Bergman PJ, Ho, H-Y, Bergin IL, Kiupel M. Prognostic Markers for Canine Melanocytic Neoplasms: A comparative review of the literature and goals for future investigation. Vet Pathol 48:54–72, 2011.
- Smedley RC, Thaiwong T, Deeth LE, Kiupel M. Correlation Between KIT Expression and c-Kit Mutations in 2 Subtypes of Canine Oral Melanocytic Neoplasms. Vet Pathol 58:683–691. 2021.
- Smedley RC, Sebastian K, Kiupel M. Diagnosis and Prognosis of Canine Melanocytic Neoplasms. Vet Sci 9:175, 2022.
- Smedley R, Bongiovanni L, Bacmeister C, Clifford CA, Christensen N, Dreyfus JM, Gary JM, Pavuk A, Rowland PH, Swanson C, Tripp C, Woods P, Bergman PJ. Diagnosis and histopathologic prognostication of canine melanocytic neoplasms: A consensus of the Oncology-Pathology Working Group. Vet Comp Oncol 20(4):739-751, 2022a.
- Smith SH, Goldschmidt M, McManus PM. A Comparative Review of Melanocytic Neoplasms. Vet Pathol 39: 651–678, 2002.
- Spangler WL and Kass PH. The Histologic and Epidemiologic Bases for Prognostic Considerations in Canine Melanocytic Neoplasia. Vet Pathol 43:136–149, 2006.
- Spugnini EP, Filipponi M, Romani L, Dotsinsky I, Mudrov N, Baroni A, Ruocco E, Laieta MT, Montesarchio V, Cassandro R, Citro G, Baldi A. Local control and distant metastasis after electrochemotherapy of a canine anal melanoma. In Vivo 21(5):897-9, 2007.
- Tellado MN, Maglietti FH, Michinski SD, Marshall GR, Signori E. Electrochemotherapy in treatment of canine oral malignant melanoma and factors influencing treatment outcome. Radiol Oncol 54(1): 68-78, 2020.
- Treggiari E, Grant JP, North SM. A retrospective review of outcome and survival following surgery and adjuvant xenogeneic DNA vaccination in 32 dogs with oral malignant melanoma. J Vet Med Sci 78 (5):845-850, 2016.
- Tsoi MF, Thaiwong T, Smedley R.C, Noland E, Kiupel M. Quantitative Expression of TYR, CD34, and CALD1 Discriminates Between Canine Oral Malignant Melanomas and Soft Tissue Sarcomas. Front Vet Sci 8, 701457, 2021.
- Tuohy JL, Selmic LE, Worley DR, Ehrhart NP, Withrow SJ. Outcome following curative-intent surgery for oral melanoma in dogs: 70 cases (1998-2011). J Am Vet Med Assoc 245(11):1266-1273, 2014.
- Turek M, LaDue T, Looper J, Nagata K, Shiomitsu K, Keyerleber M, Buchholz J, Gieger T, Hetzel S. Multimodality treatment including ONCEPT for canine oral melanoma: a retrospective analysis of 131 dogs. Vet Radiol Ultrasound 61(4):471-480, 2020.
- Vargas THM, Pulz LH, Ferro DG, Sobral RA, Venturini MAFA, Corrêa HL, Strefezzi RF. Galectin-3 Expression Correlates with Post-surgical Survival in Canine Oral Melanomas. J Comp Pathol 173:49–57, 2019.
- Verganti S, Berlato D, Blackwood L, Amores-Fuster I, Polton GA, Elders R, Doyle R, Taylor A, Murphy S. Use of Oncept melanoma vaccine in 69 canine oral malignant melanomas in the UK. J Small Anim Pract 58(1):10-16, 2017.
- Vinayak A, Frank CB, Gardiner DW, Thieman-Mankin KM, Worley DR. Malignant anal sac melanoma: eleven cases (2000 to 2015). J Small Anim Pract 58(4):231-237, 2017.
- Wainberg SH, Oblak ML, Giuffrida MA. Ventral cervical versus bilateral lateral approach for extirpation of mandibular and medial retropharyngeal lymph nodes in dogs. Vet Surg 47(5): 629-633, 2018.
- Williams LE and Packer RA. Association between lymph node size and metastasis in dogs with oral malignant melanoma: 100 cases (1987–2001). J Am Vet Med Assoc 222:1234–1236, 2003.
- Willcox JL, Spriet M, Zwingenberger AL, Phillips KL, Burton JH, Skorupski KA, Hansen KS, Affolter VK, Woolard KD, Beylin D et al. Evaluation of accuracy for 18 F-FDG positron emission tomography and computed tomography for detection of lymph node metastasis in canine oral malignant melanoma. Vet Comp Oncol 19:463–47, 2021.
- Wobeser BK, Kidney BA, Powers BE, Withrow SJ, Mayer MN, Spinato MT, Allen AL. Diagnoses and clinical outcomes associated with surgically amputated canine digits submitted to multiple veterinary diagnostic laboratories. Vet Pathol 44:355–361, 2007.
- Wouda RM, Hocker SE, Higginbotham ML. Safety evaluation of combination carboplatin and toceranib phosphate (Palladia) in tumour-bearing dogs: A phase I dose finding study. Vet Comp Oncol 16(1):E52-E60, 2018.
- Xia Y, Taiching Liao A, Lee J. A retrospective study of chemotherapeutic effect without wide-margin surgery or radiation therapy in dogs with oral malignant melanoma. Can Vet J 65(4):343-350, 2024.
- Yokoe I, Azuma K, Hata K, Mukaiyama T, Goto T, Tsuks T, Imagawa T, Ith N, Murahata Y, Osaki S, Okamoto Y. Clinical systemic lupeol administration for canine oral malignant melanoma. Mol Clin Oncol 3(1):89-92, 2015.
Selina Iussich, Med. Vet., MSC-SMAL, Patologa di MYLAV
Paolo Buracco, Med. Vet. EBVS European Specialist in Veterinary Surgery (Dipl. ECVS); Esperto in Chirurgia ed Oncologia di MYLAV
Commenti
- Nessun commento trovato








Lascia i tuoi commenti
Login per inviare un commento
Posta commento come visitatore